
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Le kit de transport de virus de BABIO obtient l'autorisation 510(k) de la FDA
2025-10-30
Le kit de transport de virus de BABIO obtient l'autorisation 510(k) de la FDA
Jinan, Chine – octobre 2025— BABIO Biotechnology, un fabricant chinois renommé de réactifs de diagnostic médical, annonce fièrement que sonKit de transport de virus (non inactivant)a reçuAutorisation FDA 510(k) (K250205), validant officiellement sa conformité aux normes réglementaires américaines.
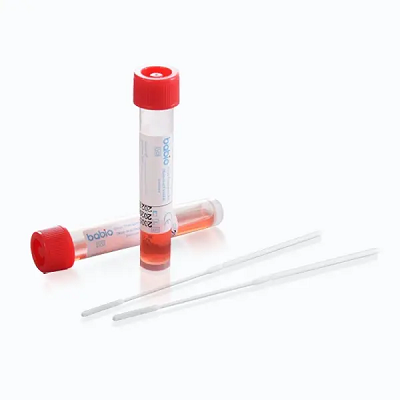
Cette étape importante renforce le leadership mondial de BABIO dans les solutions de transport d’échantillons cliniques. Le kit est conçu pour une collecte sûre et stable d'échantillons viraux, prenant en charge des applications en aval telles queRT-PCR, culture virale, etdiagnostic moléculaire. Il comporte :
-
✅ Stabilité de la température ambiante
-
✅ Solution de Hank améliorée avec des antibiotiques
-
✅ Tubes coniques sans DNase/RNase
-
✅ Écouvillons de flocage sécurisés avec conception de point d'arrêt
Disponible en plusieurs volumes de remplissage (1 ml à 6 ml) et tailles de conditionnement (20 à 500 tubes), le kit est idéal pour les hôpitaux, les laboratoires et les établissements de santé publique du monde entier.
Avec uncapacité de production quotidienne de 100 000 unités, BABIO garantit un approvisionnement constant et des prix compétitifs. Confiance dans leÉtats-Unis, Allemagne, et au-delà, BABIO continue d'offrir innovation et fiabilité dans les systèmes de transport de virus. Pour en savoir plus, consultez https://www.babiocorp.com.
#VirusTransportKit # FDA510k #BABIO #ClinicalDiagnostics #VTM #RT-PCR #GlobalHealthcare #MedicalDevices #SpecimenCollection


